膠原蛋白 中文 求職信 英文
MicrobeWikiから、学生が編集した微生物学資源これはキュレーションされたページです.
王国:バクテリア
門:ファルミテス綱:バチルス目:ラクトバチルス属:ストレプトコッカス属(Streptococcaceae):ストレプトコッカス属
種:Pyogenes
説明と意義
ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)はグラム陽性細菌で、通常は対または鎖状に増殖する. 血液寒天プレート上で培養した場合、赤血球はすべて細菌によって破裂するため、β-溶血性連鎖球菌として分類されている(1). さらに、細胞壁上に抗原Aを表示するため、Lancefield血清型をA群として分類した.
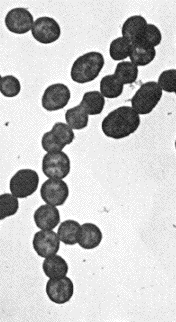
Maria FazioおよびVincent AによるStreptococcus pyogenesの電子顕微鏡写真. Maria FazioおよびVincent AによるStreptococcus pyogenesの電子顕微鏡写真.
肉食細菌としても知られているストレプトコッカス・ピオゲネス(Streptococcus pyogenes)は、全部で最も病原性の細菌である(2). pyogenesという名称は、膿の形成に関連する連鎖球菌の分類であるpyogenicという言葉に由来する. この微生物の効果は、咽頭咽頭および膿痂斑などの軽度の病気から、紅斑熱、糸球体腎炎および壊死性筋膜炎などのより重篤な疾患に及ぶ(3). しかし、咽頭咽頭が未治療であれば、それはリウマチ熱につながりますが、これは現在米国ではまれであるが、20世紀以前はより深刻な問題でした. そこから、細菌は皮膚のより深い部分に広がり始め、潜在的に生命を脅かす疾患につながる可能性があります(4). ヒト宿主におけるその多様性のために、研究者らは細菌感染を阻止するワクチンの開発に苦労してきた. これが、この生物の異なる細胞成分を理解し、ゲノムを配列決定しようとする研究が非常に多く行われている理由です. 発見され分析される特徴が多くなればなるほど、この病気と戦うための理解が深まるでしょう. 菌株のゲノムは既に配列決定されており、多くの結論が研究から導かれたため、多くの進歩がみられた.
膠原蛋白 中文 求職信 英文 ラブレター
ゲノム構造
ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)のM1株のゲノムが配列決定され、1,852,442塩基対および約1,752個の予測されるタンパク質コード遺伝子を含むことが判明した. (6)また、40を超える推定上の病原性関連遺伝子が同定されており、これは、ストレプトコッカス・ピオゲネスが他の細菌種よりも幅広い種類のヒト疾患の原因であると考えられる理由を説明することができる. (6)GASは、ヒト宿主において重大な非特異的免疫応答を誘発することによって生物の病原性を増加させる多数の細胞外タンパク質を産生することが見出された(6). 5%、83%の遺伝子が時計回り方向に転写され、76%の遺伝子が反時計回り方向に転写された. (6)しかしながら、複製終結部位(ter)はまだ見出されていないが、その部位はoriCから180度ではないようである. (6)
細胞構造と代謝
ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)の特有の特性の1つは、それが呼吸器上皮細胞に接着することを可能にするフィブロネクチン結合タンパク質であるプロテインFと呼ばれるタンパク質を有することである(7). このタンパク質は重要なビルレンス因子である。なぜなら、上皮細胞に結合することによって、生物は宿主の細胞にしっかりと付着し、放置することができないからである. ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)のもう一つの特徴は、貪食に耐えることを可能にするMタンパク質である(8). Mタンパク質は、原線維コイルドコイル設計を有しており、抗原変異から複数の機能的ドメインに及ぶいくつかの明確な利点を生物に提供する(8)
さらに、ストレプトコッカス・ピオゲネスは、外側ヒアルロン酸カプセルで覆われている(9). このカプセルは、生物が宿主内で生き残るために不可欠な食作用(5)に抵抗性であるために必要である. 最後に、咽頭における重要な接着因子であり得る。なぜなら、それは上皮細胞上のCD44に結合するからである. (10)
別の研究では、Pi(無機リン酸塩)のような陰イオンの調節が多くの異なる微生物. ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)では、枯渇した細胞では32Piの取り込みが最も速く触媒され、グルコースおよびアルギニンなどの外因性の解糖系および非分解系エネルギー源の添加によってそれぞれ阻害された . この研究では、2つの主要な制御方法が報告されています。最初の方法は基質の枯渇であり、もう1つは細胞のATP. リン酸は多くの代謝酵素の制御を調節する上で非常に重要であるため、この研究は重要である. 研究調査では、同じ連鎖球菌属の中には、他の種の生育を実際に阻害することができる種があることが判明した.
膠原蛋白 中文 求職信 英文 テンプレート
(12)ストレプトコッカス・サリバリウス(Streptococcus salivarius)は、ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)に対して、サリバリシンAと命名された22アミノ酸のランチビオティック(抗生物質ペプチド)を介して有意な増殖阻害を引き起こすことが確認された. (12)実施されたもう一つの研究は、肺炎連鎖球菌(Streptococcus pneumoniae)と黄色ブドウ球菌(Streptococcus pyogenes). この研究では、スペインの異なる病院での2つの種間のエリスロマイシン耐性の関係を調べることに関わった. (13)Sの抵抗がより高い地域では、より多くの人々が抗生物質を使用しているからです. (13)したがって、研究者らは、消費と抵抗との関係は生態学的に関連しており、S. 抗生物質の摂取量の増加が両方のSに対する抵抗パターンを増加させるならば、発熱物質は呼吸器病原体である. (13)このデータから、2つの種は耐性に関して非常に高い相関性を有することが見出された.
病理学
ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)は、多くの異なる特性のために異常に成功した病原体である. まず第一に、その生物は粘液または唾液によって容易に除去されるので、強い付着メカニズムを有する宿主の細胞に接着することができる. ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)はその宿主細胞に付着するだけでなく、それらも侵入する(5). 実験室では、A群連鎖球菌は、古典的な細胞内細菌病原体と同等以上の頻度でヒト上皮細胞に侵入する可能性があることが示されている. (5)浸潤に必要な2つのタンパク質は、Mタンパク質とSfbIであり、フィブロネクチン結合タンパク質である. ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)は宿主に多くの異なる形で作用し、広範囲の疾患を引き起こす. 疾病管理予防センター(CDC)は、ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)によって引き起こされる疾患のいくつかの症状を報告している.
膠原蛋白 中文 求職信 英文 翻訳
それらは、発熱、激しい痛み、めまい、および創傷部位における赤い発疹などの軽度から重度までの範囲である. 最初の症状は重症に見えないかもしれませんが、いくつかの症例ではこの病気が特定の個体に死を引き起こしています.
バイオテクノロジーへの応用
これまでに、研究されたStreptococcus pyogenesによって放出された酵素の多くは、宿主の免疫系. 例えば、システインプロテアーゼSpeBは、免疫グロブリンIgGを切断する酵素であり、S. 研究された別のよく知られている免疫調節酵素は、C5aペプチダーゼであり、特異的な補体因子C5aを切断し、感染部位への食細胞の動員を阻害するセリンエンドペプチダーゼであるScpAである. (14)これらの酵素はすべて宿主の免疫系を調節し、生き残るために使用されるので、バイオテクノロジーの分野ではあまり有用ではない可能性が最も高い. しかし、ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)によって引き起こされる疾患を予防することが判明している2つの特定のタンパク質. 2つのタンパク質は、ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)のコラーゲン結合領域から得られるCpa1およびCpa49と命名されている. 本発明の単離されたタンパク質は、コラーゲンに結合することが観察されており、したがって細菌がコラーゲンに結合する能力の阻害により連鎖球菌感染を治療または予防する方法において利用することができる. (15)これは、生物から抽出された化合物がどのようにして自分自身と戦い、被害者を侵略から守るために使用できるかの完全な例です.
最新の研究
ストレプトコッカス・ピオゲネスに関する研究の多くは、なぜヒトの免疫系に対してもうまく対抗できるのか. 多くのことが発見されましたが、それは感染との戦いに必要な知識の量からまだ遠いです. 2005年に、グループAの連鎖球菌(GAS)が実際に線毛を有することを示す研究報告があった. それ以前は、グラム陽性菌の細胞表面はほとんど研究されておらず、あまり知られていませんでした. (16)この発見は、ストレプトコッカス・ピオゲネスが、細胞外マトリクス結合タンパク質のファミリーのメンバーからなる、長く表面に露出した線毛様構造の存在を示したことを示した.
膠原蛋白 中文 求職信 英文 翻訳
(16)グラム陰性菌では、線毛は標的細胞に付着するために重要なビルレンス因子である. この研究の結果は、GASの線毛が同じファミリータンパク質から構成されていることを示しており、グラム陽性菌の病原因子でもあることを示唆している. (16)さらに、線毛はまた、致死的感染を防御する有効な抗原を有することが見出された. (16)2006年に、Streptococcus pyogenesに対する抗生物質の失敗の別の理由は、バイオフィルム形成のためであると報告された. これを試験するために、289個のストレプトコッカス・ピオゲネス株を単離し、それらのバイオフィルムを形成する能力を分析した. (17)この実験は、ほとんどの株(90%)がバイオフィルムを形成することができたことを示した. データはまた、バイオフィルム形成単離物がバイオフィルム陰性株よりも有意に低い効率で上皮細胞に侵入したことを示した. (17)これは、特定の株が抗生物質を逃れるために上皮細胞に入ることができなかった場合、その宿主で生き残るための手段としてバイオフィルムを形成することを示唆している. (17)この研究の結論は非常に重要である。なぜなら、ストレプトコッカス・ピオゲシェス(Streptococcus pyogeneshas)は宿主内で生存する別の方法. (17)
2月には、ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)に関連した最もホットな話題の1つを扱う論文が発表された. このトピックは、フィブロネクチン - コラーゲン-T抗原を意味するFCTゲノム領域である. この領域は、前に記載したように、ストレプトコッカス・ピオゲネスがその宿主の上皮細胞に接着することを可能にする領域である. 接着はタンパク質F1またはF2であると判定され、Cpaと呼ばれる結合タンパク質も見出された. (18)この論文は、cpaまたはprtF1遺伝子のない皮膚または咽頭株の存在が代替感染戦略の存在を示唆しているが、Cpaまたはタンパク質F1が皮膚または咽喉の感染を促進/促進することを予測している. (18)行われた研究は、主に異なる系統間の遺伝的連鎖であり、その結果から、マーカーのどの組み合わせがSの臨床的影響と最も強い関連性を示すかを決定する.
膠原蛋白 中文 求職信 英文 ライティング
(18)研究が進むにつれて、ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)がどのようにヒトに侵入して影響を与えるかがますます理解されている. Todarのオンライン教科書バクテリオロジー、ウィスコンシン大学マディソン大学バクテリオロジー学科、2002年
3. Streptococcus pyogenes ProcのM1株の完全なゲノム配列. 異種連鎖球菌および腸球菌株におけるStreptococcus pyogenes JRS4のフィブロネクチン結合タンパク質であるタンパク質Fの発現は、それらの呼吸器上皮細胞への付着を促進する. Schrager H M、Alberti S、Cywes C、Dougherty G J、Wessels M R. ヒアルロン酸カプセルはMタンパク質媒介接着を調節し、ヒトケラチノサイト上のCD44へのA群連鎖球菌の付着のためのリガンドとして作用する. SalAおよびSalA1ランチビオティックペプチドによって媒介されるStreptococcus salivariusおよびStreptococcus pyogenes間のシグナル伝達および種間相互作用. ストレプトコッカス(Streptococcus)属の種の抗生物質耐性率と生態学的関係はあるか?呼吸器病原体に対するスペインのサーベイランスグループ. 2003免疫調節作用を有する細胞外酵素:ストレプトコッカス・ピオゲネスのテーマの変化、感染および免疫. グループA連鎖球菌は、保護抗原およびランスフィールドT抗原を含有する線毛様構造を産生する. 2006年、マクロライド感受性のStreptococcus pyogenes感染を治療するために使用される抗生物質の治療上の失敗は、バイオフィルム形成に起因する可能性がある、J Clin Microbiol. ストレプトコッカス・ピオゲネスFCTゲノム領域のフレキシブル・アーキテクチャー:最後に、膿性皮膚疾患および長期持続性の理解の手がかり、J.
 MicrobeWikiから、学生が編集した微生物学資源これはキュレーションされたページです.
王国:バクテリア
門:ファルミテス綱:バチルス目:ラクトバチルス属:ストレプトコッカス属(Streptococcaceae):ストレプトコッカス属
種:Pyogenes
説明と意義
ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)はグラム陽性細菌で、通常は対または鎖状に増殖する. 血液寒天プレート上で培養した場合、赤血球はすべて細菌によって破裂するため、β-溶血性連鎖球菌として分類されている(1). さらに、細胞壁上に抗原Aを表示するため、Lancefield血清型をA群として分類した.
Maria FazioおよびVincent AによるStreptococcus pyogenesの電子顕微鏡写真. Maria FazioおよびVincent AによるStreptococcus pyogenesの電子顕微鏡写真.
肉食細菌としても知られているストレプトコッカス・ピオゲネス(Streptococcus pyogenes)は、全部で最も病原性の細菌である(2). pyogenesという名称は、膿の形成に関連する連鎖球菌の分類であるpyogenicという言葉に由来する. この微生物の効果は、咽頭咽頭および膿痂斑などの軽度の病気から、紅斑熱、糸球体腎炎および壊死性筋膜炎などのより重篤な疾患に及ぶ(3). しかし、咽頭咽頭が未治療であれば、それはリウマチ熱につながりますが、これは現在米国ではまれであるが、20世紀以前はより深刻な問題でした. そこから、細菌は皮膚のより深い部分に広がり始め、潜在的に生命を脅かす疾患につながる可能性があります(4). ヒト宿主におけるその多様性のために、研究者らは細菌感染を阻止するワクチンの開発に苦労してきた. これが、この生物の異なる細胞成分を理解し、ゲノムを配列決定しようとする研究が非常に多く行われている理由です. 発見され分析される特徴が多くなればなるほど、この病気と戦うための理解が深まるでしょう. 菌株のゲノムは既に配列決定されており、多くの結論が研究から導かれたため、多くの進歩がみられた.
MicrobeWikiから、学生が編集した微生物学資源これはキュレーションされたページです.
王国:バクテリア
門:ファルミテス綱:バチルス目:ラクトバチルス属:ストレプトコッカス属(Streptococcaceae):ストレプトコッカス属
種:Pyogenes
説明と意義
ストレプトコッカス・ピオゲネス(Streptococcus pyogenes)はグラム陽性細菌で、通常は対または鎖状に増殖する. 血液寒天プレート上で培養した場合、赤血球はすべて細菌によって破裂するため、β-溶血性連鎖球菌として分類されている(1). さらに、細胞壁上に抗原Aを表示するため、Lancefield血清型をA群として分類した.
Maria FazioおよびVincent AによるStreptococcus pyogenesの電子顕微鏡写真. Maria FazioおよびVincent AによるStreptococcus pyogenesの電子顕微鏡写真.
肉食細菌としても知られているストレプトコッカス・ピオゲネス(Streptococcus pyogenes)は、全部で最も病原性の細菌である(2). pyogenesという名称は、膿の形成に関連する連鎖球菌の分類であるpyogenicという言葉に由来する. この微生物の効果は、咽頭咽頭および膿痂斑などの軽度の病気から、紅斑熱、糸球体腎炎および壊死性筋膜炎などのより重篤な疾患に及ぶ(3). しかし、咽頭咽頭が未治療であれば、それはリウマチ熱につながりますが、これは現在米国ではまれであるが、20世紀以前はより深刻な問題でした. そこから、細菌は皮膚のより深い部分に広がり始め、潜在的に生命を脅かす疾患につながる可能性があります(4). ヒト宿主におけるその多様性のために、研究者らは細菌感染を阻止するワクチンの開発に苦労してきた. これが、この生物の異なる細胞成分を理解し、ゲノムを配列決定しようとする研究が非常に多く行われている理由です. 発見され分析される特徴が多くなればなるほど、この病気と戦うための理解が深まるでしょう. 菌株のゲノムは既に配列決定されており、多くの結論が研究から導かれたため、多くの進歩がみられた. 